Bài tập Khoa học tự nhiên 9 bài 19: Dãy hoạt động của hoá học
Bài 19: Dãy hoạt động hoá học
Giải Bài tập Khoa học tự nhiên 9 bài 19 sách Kết nối tri thức có đáp án chi tiết cho từng bài tập trong sách bài tập KHTN 9 Kết nối tri thức. Hi vọng sẽ là tài liệu giúp các em tham khảo.
Bài tập khoa học tự nhiên 9 trang 59
Bài 19.1 trang 59 Bài tập Khoa học tự nhiên 9
Trong các kim loại natri, kẽm, đồng, bạc, magnesium, kim loại nào có tính chất sau đây?
a) Tác dụng mãnh liệt với nước ở điều kiện thường, toả nhiệt mạnh và giải phóng khí hydrogen.
b) Tác dụng với dung dịch HCl giải phóng khí hydrogen.
c) Đẩy sắt ra khỏi muối của sắt trong dung dịch.
Hướng dẫn:
a) Natri
PTHH: 2Na + 2H2O → 2NaOH + H2
b) Natri, kẽm, magnesium.
PTHH:
2Na + 2HCl → 2NaCl + H2
Zn + 2HCl → ZnCl2 + H2
Mg + 2HCl → MgCl2 + H2
c) Kẽm, magnesium
Bài tập khoa học tự nhiên 9 trang 60
Bài 19.2 trang 60 Bài tập Khoa học tự nhiên 9
Sắt không tan trong dung dịch nào sau đây?
A. HCl.
B. Cu(NO3)2.
C. AgNO3.
D. Mg(NO3)2.
Hướng dẫn:
Đáp án đúng là: D
Sắt là kim loại yếu hơn Mg nên không thể đẩy Mg ra khỏi muối.
Bài 19.3 trang 60 Bài tập Khoa học tự nhiên 9
Cho thanh đồng vào dung dịch muối X không màu, thấy dung dịch xuất hiện màu xanh và có kim loại mới tạo thành bám trên thanh đồng. Muối X có thể là chất nào sau đây?
A. NaCl.
B. AlCl3.
C. Zn(NO3)2.
D. AgNO3.
Hướng dẫn:
Đáp án đúng là: D
Phản ứng xảy ra chứng tỏ Cu phải là kim loại mạnh hơn kim loại tạo muối X thì mới đẩy được kim loại đó ra khỏi muối bám vào thanh đồng.
→ Muối X là AgNO3.
PTHH: Cu + 2AgNO3 → 2Ag + Cu(NO3)2
Bài 19.4 trang 60 Bài tập Khoa học tự nhiên 9
Cho một thanh kim loại Y vào dung dịch muối CuSO4 (có màu xanh). Sau một thời gian thấy màu xanh nhạt dần và có vẩy đồng bám trên thanh kim loại Y. Y có thể là kim loại nào sau đây?
A. Cu.
B. Zn.
C. Ag.
D. Ca.
Hướng dẫn:
Đáp án đúng là: B
Kim loại Y phải hoạt động hóa học mạnh hơn Cu.
→ Y là Zn.
Bài 19.5 trang 60 Bài tập Khoa học tự nhiên 9
Điền từ thích hợp vào chỗ trống sau đây: Kim loại …(1)… trong dãy hoạt động hoá học có thể đẩy …(2)… đứng sau ra khỏi …(3)… của kim loại …(4)…
Hướng dẫn:
(1) đứng trước: (2) kim loại; (3) muối; (4) đứng sau.
Bài 19.6 trang 60 Bài tập Khoa học tự nhiên 9
Để làm sạch dung dịch copper(II) nitrate có lẫn silver nitrate, có thể dùng kim loại nào sau đây?
A. Au.
B. Ag.
C. Cu.
D. Fe.
Hướng dẫn:
Đáp án đúng là: C
Dùng thanh đồng cho vào dung dịch, khi phản ứng xảy ra hoàn toàn thì toàn bộ lượng Ag bám vào thanh đồng.
Cu + 2AgNO3 → 2Ag + Cu(NO3)2
Bài 19.7 trang 60 Bài tập Khoa học tự nhiên 9
Cho các cặp chất sau: Cu và HCl; Fe và AgNO3; Zn và Pb(NO3)2; Fe và MgSO4; Al và HCl. Có bao nhiêu cặp chất xảy ra phản ứng?
A. 2.
B. 3.
C. 4.
D. 5.
Hướng dẫn:
Đáp án đúng là: B
Có 3 cặp chất xảy ra phản ứng.
PTHH:
Fe + 2AgNO3 → 2Ag + Fe(NO3)2
Zn + Pb(NO3)2 → Pb + Zn(NO3)2
2Al + 6HCl → 2AlCl3 + 3H2
Bài 19.8 trang 60 Bài tập Khoa học tự nhiên 9
Cho một mẩu kim loại A, B, C vào nước ở điều kiện nhiệt độ thường, quan sát được hiện tượng như sau:

a) Hãy sắp xếp các kim loại A, B, C theo thứ tự độ hoạt động hoá học giảm dần.
b) Biết A là một kim loại có hoá trị II và B là một kim loại có hoá trị I. Hãy viết PTHH của phản ứng A và B với nước.
Hướng dẫn:
a) Từ hiện tượng, ta sắp xếp được: B > C > A
b)
A + 2H2O → A(OH)2 + H2
2B + 2H2O → 2BOH + H2
Bài tập khoa học tự nhiên 9 trang 61
Bài 19.9 trang 61 Bài tập Khoa học tự nhiên 9
Kali (potassium) tác dụng với nước ở ngay nhiệt độ thường. Trong khi đó kẽm (zinc) và sắt (iron) không tác dụng với nước ở nhiệt độ thường nhưng tác dụng với hơi nước ở điều kiện nhiệt độ cao.
a) Viết PTHH các phản ứng của các kim loại trên với nước. Ghi rõ điều kiện phản ứng (nếu có).
b) So sánh độ hoạt động hoá học của kali với kẽm, sắt. Từ các dữ kiện trên có thể so sánh được độ hoạt động hoá học của kẽm và sắt không?
c) Đề xuất thí nghiệm để so sánh độ hoạt động hoá học của kẽm và sắt.
d) Dựa vào dãy hoạt động hoá học, cho biết kim loại kẽm hay sắt hoạt động hoá học mạnh hơn? Viết PTHH minh hoạ.
Hướng dẫn:
a) PTHH:
2K + 2H2O → 2KOH + H2
Zn + H2O to→→to ZnO + H2
3Fe + 4H2O to→→to Fe3O4 + 4H2
b) Kali hoạt động hoá học mạnh hơn sắt và kẽm.
Từ dữ kiện trong bài không so sánh được độ hoạt động hoá học của kẽm và sắt.
c) Để so sánh độ hoạt động của kẽm và sắt có thể thực hiện hai thí nghiệm:
(1) Nhúng một lá kẽm vào dung dịch muối Fe(II) (ví dụ: FeCl2, FeSO4).
(2) Nhúng một miếng sắt vào dung dịch muối Zn (ví dụ ZnCl2, ZnSO4).
– Nếu thí nghiệm (1) xảy ra phản ứng thì Zn hoạt động hoá học mạnh hơn Fe.
– Nếu thí nghiệm (2) xảy ra phản ứng thì Fe hoạt động hoá học mạnh hơn Zn.
d) Thực tế, Zn hoạt động hoá học mạnh hơn Fe.
Phản ứng minh họa: Zn + FeCl2 → ZnCl2 + Fe
Bài 19.10 trang 61 Bài tập Khoa học tự nhiên 9
Cho một mẩu kali vào dung dịch CuSO4, quan sát thấy bọt khí thoát ra và xuất hiện kết tủa màu xanh. Hãy viết các PTHH để giải thích các hiện tượng quan sát được.
Hướng dẫn:
2K + 2H2O → 2KOH + H2 ↑
Khí thoát ra
2KOH + CuSO4 → Cu(OH)2 ↓ + K2SO4
Kết tủa xanh
Bài 19.11 trang 61 Bài tập Khoa học tự nhiên 9
Cho các kim loại được kí hiệu là X, Y, Z, T lần lượt tác dụng với nước cất và với dung dịch HCl. Hiện tượng quan sát được như sau:
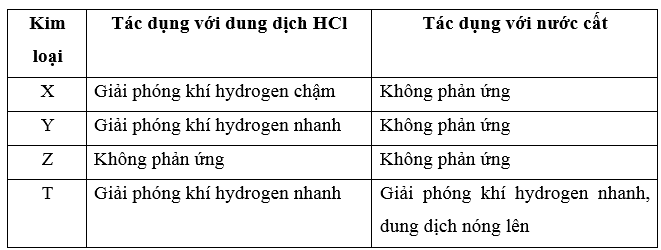
a) Hãy sắp xếp các kim loại X, Y, Z, T theo trật tự độ hoạt động hoá học giảm dần.
b) Cho biết vị trí của các kim loại so với H trong dãy hoạt động hoá học.
Hướng dẫn:
a) Thứ tự các kim loại sắp xếp theo độ hoạt động hóa học giảm dần: T > Y > X > Z.
b) T, Y, X đứng trước H trong dãy hoạt động hóa học do phản ứng được với acid HCl.
Z đứng sau H trong dãy hoạt động hóa học do không phản ứng với acid HCl.
Bài 19.12 trang 61 Bài tập Khoa học tự nhiên 9
Thực hiện thí nghiệm với một kim loại X chưa biết tên, kết quả thu được như sau:
– X đẩy được sắt ra khỏi muối FeSO4 trong dung dịch.
– X không phản ứng với nước ở điều kiện nhiệt độ thường.
Trong các câu phát biểu sau, câu nào đúng, câu nào sai?
a) X hoạt động hoá học mạnh hơn sắt.
b) X phản ứng được với dung dịch HCl sinh ra khí H2.
c) X có thể phản ứng với hơi nước ở nhiệt độ cao.
Hướng dẫn:
a) Đúng.
b) Đúng.
c) Đúng.
Bài tập khoa học tự nhiên 9 trang 62
Bài 19.13 trang 62 Bài tập KHNT 9
Thực hiện thí nghiệm: cho một mẩu kim loại X, Y, Z vào nước ở điều kiện thường. Kết quả nhận thấy: X phản ứng với nước và có khí thoát ra; Y và Z không phản ứng.
Trong các câu phát biểu sau, câu nào đúng, câu nào sai?
a) X hoạt động hoá học mạnh hơn Y.
b) X hoạt động hoá học mạnh hơn Z.
c) Y và Z có độ hoạt động hoá học mạnh tương đương nhau.
d) Y và Z đều không phản ứng với HCl trong dung dịch nước.
Hướng dẫn:
a) Đúng.
b) Đúng.
c) Sai.
d) Sai.
Bài 19.14 trang 62 Bài tập Khoa học tự nhiên 9
Đề xuất phương pháp điều chế Ag từ dung dịch AgNO3.
Hướng dẫn:
Ta dùng kim loại hoạt động hóa học mạnh hơn Ag như Zn, Fe để đẩy Ag ra khỏi muối.
PTHH: Zn + 2AgNO3 → 2Ag + Zn(NO3)2
Fe + 2AgNO3 → 2Ag + Fe(NO3)2
Bài 19.15 trang 62 Bài tập KHTN 9
Để hàn hai miếng kim loại, người ta có thể sử dụng phương pháp hàn nhiệt nhôm. Trong phương pháp hàn này hỗn hợp gồm bột oxide kim loại và bột nhôm được đốt cháy để xảy ra phản ứng (phản ứng nhiệt nhôm). Phản ứng này toả nhiệt rất lớn, sinh ra kim loại ở trạng thái nóng chảy và aluminium oxide (Al2O3). Kim loại nóng chảy này sẽ điền đầy khe hàn.
Phản ứng nhiệt nhôm thường được sử dụng để hàn hai miếng đồng hoặc hai miếng gang, thép (thành phần chính là sắt).
a) Viết PTHH của phản ứng nhiệt nhôm trong trường hợp:
– Bột iron(III) oxide phản ứng với bột nhôm.
– Bột copper(II) oxide phản ứng với bột nhôm.
b) Hãy chọn hỗn hợp ở cột (A) phù hợp để hàn hai thanh kim loại ở cột (B) trong bảng sau:

c) Dựa vào dãy hoạt động hoá học hãy giải thích: tại sao có thể dùng bột nhôm để thực hiện phản ứng với nhiều oxide kim loại?
Hướng dẫn:
a) $2\text{Fe}_2\text{O}_3 + 4\text{Al} \xrightarrow{\text{t}\,o} 2\text{Al}_2\text{O}_3 + 4\text{Fe}$
b) $3\text{CuO} + 2\text{Al} \xrightarrow{\text{t}\,o} \text{Al}_2\text{O}_3 + 3\text{Cu}$
b) 1 – z; 2 – t; 3 – y.
c) Có thể dùng bột nhôm để thực hiện phản ứng với nhiều oxide kim loại là do kim loại nhôm có độ hoạt động hóa học mạnh nên phản ứng được với nhiều oxide kim loại.
