Bài tập Khoa học tự nhiên 9 bài 23:Alkane
Sách Bài tập khoa học tự nhiên 9 Bài 23 (Kết nối tri thức): Alkane
Giải Bài tập Khoa học tự nhiên 9 bài 23 sách Kết nối tri thức có đáp án chi tiết cho từng bài tập trong sách bài tập KHTN 9 Kết nối tri thức. Hi vọng sẽ là tài liệu giúp các em tham khảo.
Bài tập khoa học tự nhiên 9 bài 23 trang 69
Bài 23.1 trang 69 Bài tập KHTN 9
Trong số các CTPT sau đây, có bao nhiêu CTPT biểu diễn các chất thuộc loại hydrocarbon?
(1) C8H18; (2) C2H4O2; (3) C2H6; (4) C2H6O; (5) CH3Cl; (6) C5H12.
A. 3.
B. 2.
C. 4.
D. 5.
Hướng dẫn:
Đáp án đúng là: A
Hydrocarbon là loại hợp chất hữu cơ mà thành phần phân tử chỉ chứa các nguyên tố carbon và hydrogen.
Trong số các CTPT, có 3 CTPT biểu diễn các chất thuộc loại hydrocarbon là: (1), (3) và (6).
Bài 23.2 trang 69 Bài tập KHTN 9
Chất nào sau đây không thuộc loại alkane?
A. 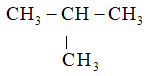 .
.
B. CH4.
C. CH2 = CH2.
D. CH3 – CH3.
Hướng dẫn:
Đáp án đúng là: C
Alkane là những hydrocarbon mạch hở, phân tử chỉ chứa các liên kết đơn.
Vậy chất ở ý A, B, D là alkane; C là alkene.
Bài 23.3 trang 69 Bài tập KHTN 9
CTPT nào sau đây biểu diễn chất thuộc loại alkane?
A.C3H8.
B. C6H6.
C. C2H4.
D. C2H6O.
Hướng dẫn:
Đáp án đúng là: A
Alkane có công thức chung là CnH2n+2 (n≥1n≥1, n là số nguyên, dương).
Vậy CTPT C3H8 biểu diễn chất thuộc loại alkane.
Bài 23.4 trang 69 Bài tập KHTN 9
Alkane nào sau đây có mạch phân nhánh?
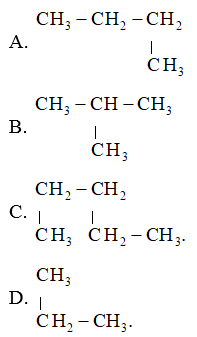
Hướng dẫn:
Đáp án đúng là: B
A, C, D sai vì là các alkane không nhánh (Mạch C thẳng).
Bài 23.5 trang 69 Bài tập KHTN 9
Propane có 3 nguyên tử C trong phân tử và là ankane có tính chất tương tự methane.
a) Viết CTPT của propane.
b) Viết PTHH của phản ứng đốt cháy propane.
c) Nhận xét về mối quan hệ giữa số mol CO2 và H2O sinh ra khi đốt cháy methane, propane.
Hướng dẫn:
a) CTPT của propane là C3H8.
b) PTHH của phản ứng đốt cháy propane:
$\text{C}_3\text{H}_8 + 5\text{O}_2 \xrightarrow{t^\circ} 3\text{CO}_2 + 4\text{H}_2\text{O}$
c) Mối quan hệ giữa số mol CO2 và H2O sinh ra khi đốt cháy methane, propane là:
Số mol CO2 sinh ra nhỏ hơn số mol H2O sinh ra.
Bài tập khoa học tự nhiên 9 bài 23 trang 70
Bài 23.6 trang 70 Bài tập KHTN 9
Phát biểu nào sau đây đúng?
A. Alkane là các hydrocarbon mà phân tử chỉ có liên kết đơn.
B. Phân tử alkane chỉ có mạch carbon không nhánh.
C. Khi alkane cháy, số mol H2O sinh ra nhỏ hơn hoặc bằng số mol CO2.
D. Trong CTPT của alkane, khi tăng thêm một nguyên tử C thì số nguyên tử H tăng lên 2.
Hướng dẫn:
Đáp án đúng là: D
A sai vì alkane là các hydrocarbon mạch hở mà phân tử chỉ có liên kết đơn.
B sai vì phân tử alkane có mạch carbon không nhánh, mạch carbon nhánh.
C sai vì khi alkane cháy, số mol H2O sinh ra lớn hơn hoặc bằng số mol CO2.
D đúng vì alkane có công thức chung là CnH2n+2 (n≥1n≥1, n là số nguyên, dương). Vậy khi tăng thêm một nguyên tử C thì số nguyên tử H tăng lên 2.
Bài 23.7 trang 70 Bài tập KHTN 9
Trong các chất sau đây, có bao nhiêu chất thuộc loại alkane?
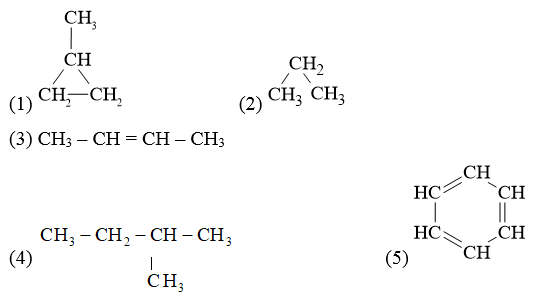
A. 4.
B. 2.
C. 3.
D. 1.
Hướng dẫn:
Đáp án đúng là: B
Alkane là những hydrocarbon mạch hở, phân tử chỉ chứa các liên kết đơn.
Vậy chất thuộc alkane là (2) và (4).
Bài 23.8 trang 70 Bài tập KHTN 9
Ở điều kiện 25 °C, 1 bar, 2 L hydrocarbon X có khối lượng bằng 1 L khí oxygen. Xác định CTPT của hydrocarbon X.
Hướng dẫn:
2 L hydrocarbon X có khối lượng bằng 1 L khí oxygen → Khối lượng mol của hydrocarbon X bằng 1/2 khối lượng mol của khí oxygen = 16 g/mol.
Đặt CTPT của hydrocarbon X là CxHy.
Ta có: 12x + y = 16
$\Rightarrow \begin{cases} x = 1 \\ y = 4 \end{cases}$
CTPT của hydrocarbon X là CH4.
Bài 23.9 trang 70 Bài tập KHTN 9
Trình bày phương pháp hoá học để phân biệt ba khí: methane, carbon dioxide, hydrogen.
Hướng dẫn:
Bước 1: Đốt ba loại khí trên.
– Khí không cháy là carbon dioxide.
– Còn lại methane và hydrogen đều cháy:
$\text{CH}_4 + 2\text{O}_2 \xrightarrow{t^\circ} \text{CO}_2 + 2\text{H}_2\text{O} \\
2\text{H}_2 + \text{O}_2 \xrightarrow{t^\circ} 2\text{H}_2\text{O}$
Bước 2: Dẫn sản phẩm cháy vào dung dịch nước vôi trong dư.
– Sản phẩm cháy nào làm vẩn đục dung dịch nước vôi trong dư là sản phẩm cháy của methane:
CO2 + Ca(OH)2 → CaCO3↓ + H2O
– Còn lại là sản phẩm cháy của hydrogen không có hiện tượng.
Bài 23.10 trang 70 Bài tập KHTN 9
Một loại khí biogas có chứa 60% CH4 về thể tích. Nhiệt lượng sinh ra khi đốt cháy 1 mol methane là 891 kJ
a) Tính nhiệt lượng sinh ra khi đốt cháy 50 L khí biogas. Biết rằng các khí khác trong thành phần biogas khi cháy sinh ra nhiệt lượng không đáng kể.
b) Nhiệt lượng sinh ra khi đốt cháy 1 mol propane là 2 220 kJ.Tính khối lượng propane cần thiết để khi đốt sinh ra nhiệt lượng bằng nhiệt lượng khi đốt cháy lượng khí biogas ở câu a). (Các thể tích khí đều đo ở 25 °C, 1 bar).
c) Để cung cấp một lượng nhiệt như nhau, đốt methane hay propane (khí trong thành phần khí mỏ dầu) sẽ thải khí CO2 ra ngoài môi trường ít hơn?
Hướng dẫn:
a) Số mol CH4 trong 50L biogas:
$\frac{50}{24,79}$.$\frac{60}{100}$= 1,21$ (mol)
Nhiệt lượng sinh ra khi đốt 50 L biogas này được xác định gần đúng là nhiệt lượng sinh ra khi đốt 1,21 mol CH4:
Q = 1,21 . 891 = 1078,11 (kJ)
b) Khi đốt cháy 1 mol propane sinh ra 2 220 kJ.
Khi đốt cháy x mol propane sinh ra 1 078,11 kJ.
Tính ra x= $\frac{1078,11}{2220}$ = 0,49 (mol)
→ Khối lượng propane cần thiết là: m = 0,49.44 = 21,56 gam
c) Phản ứng cháy của methane: $\text{CH}_4 + 2\text{O}_2 \xrightarrow{t^\circ} \text{CO}_2 + 2\text{H}_2\text{O}$
Vậy: số mol CO2 sinh ra bằng số mol CH4.
Thể tích khí CO2 thải ra ngoài môi trường: V = 1,21 . 24,79 ≈≈ 30,00 (L).
Phản ứng cháy của propane: $\text{C}_3\text{H}_8 + 5\text{O}_2 \xrightarrow{t^\circ} 3\text{CO}_2 + 4\text{H}_2\text{O}$
Số mol: 0,49 1,47
Thể tích khí CO2 thải ra ngoài môi trường: V = 1,47 . 24,79 ≈≈36,44 (L).
Để tạo ra một lượng nhiệt như nhau, đốt khí methane sẽ thải khí CO2 ra ngoài môi trường ít hơn đốt propane.
