Giải sgk Hoá học 10 bài 4: Cấu trúc lớp vỏ electron của nguyên tử
Giải sgk Hoá học 10 bài 4: Cấu trúc lớp vỏ electron của nguyên tử
Giải sgk Hoá học 10 bài 4: Cấu trúc lớp vỏ electron của nguyên tử có đáp án chi tiết cho từng bài tập trong sách giáo khoa Hoá học 10 Chân trời sáng tạo. Mời các em học sinh cùng quý phụ huynh tham khảo.
Câu hỏi
Câu 1 trang 26 SGK Hóa 10 CTST
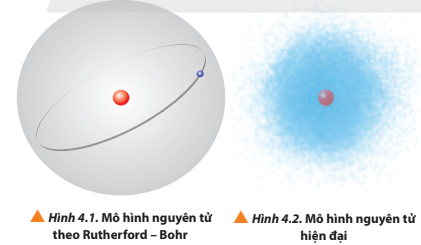
Quan sát Hình 4.1 và 4.2, so sánh điểm giống nhau và khác nhau giữa mô hình Rutherford – Bohr với mô hình hiện đại mô tả sự chuyển động của electron trong nguyên tử.
Hướng dẫn giải
Giống nhau: Electron đều chuyển động xung quanh hạt nhân
Khác nhau:
- Mô hình nguyên tử theo Rutherford – Bohr:
Các electron chuyển động trên quỹ đạo hình tròn hoặc bầu dục xác định xung quanh hạt nhân
- Mô hình nguyên tử hiện đại:
Các eletron chuyển động rất nhanh xung quanh hạt nhân, không theo quỹ đạo xác định.
Câu 2 trang 27 SGK Hóa 10 CTST
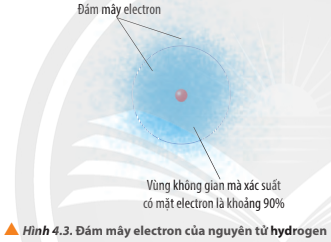
Quan sát Hình 4.3, phân biệt khái niệm đám mây electron và khái niệm orbital nguyên tử.
Hướng dẫn giải
Các electron chuyển động rấ nhanh quanh hạt nahan với xác suất tìm thấy không giống nhau tạo thành đám mây electron.
Orbital nguyên tử là khu vực không gian xung quanh hạt nhân mà tại đó xác suất có mặt electron khoảng 90%.
Câu 3 trang 27 SGK Hóa 10 CTST
Cho biết khái niệm orbital nguyên tử xuất phát từ mô hình nguyên tử của Rutherford – Bohr hay mô hình nguyên tử hiện đại.
Hướng dẫn giải
Orbital nguyên tử là khu vực không gian xung quanh hạt nhân mà tại đó xác suất có mặt (xác suất tìm thấy) electron khoảng 90%
=> Xuất phát từ mô hình nguyên tử hiện đại vì electron chuyển động không theo quỹ đạo, mật độ electron không giống nhau
Câu 4 trang 27 SGK Hóa 10 CTST
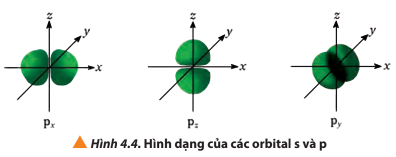
Quan sát Hình 4.4, hãy cho biết điểm giống và khác nhau giữa các orbital p (px, py, pz)
Hướng dẫn giải
Giống nhau: các orbital p (px, py, pz) đều có hình dạng là số 8 nổi
Khác nhau:
Orbital px: Nằm trên trục Ox
Orbital py: Nằm trên trục Oy
Orbital pz: Nằm trên trục Oz
Bài tập
Bài 1 trang 34 SGK Hóa 10 CTST
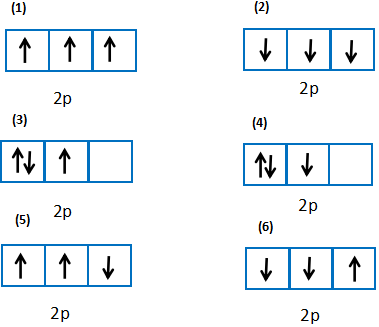
Trong các cách biểu diễn electron và các orbital của phân lớp 2p ở trạng thái cơ bản, hãy chọn cách phân bố đúng:
Hướng dẫn giải bài tập
(1): đúng vì chứa tối đa electron và biểu diễn electron độc thân bằng mũi tên đi lên
(2): sai vì số electron độc thân chưa tối đa
(3): sai vì biểu diễn 1 electron độc thân bằng mũi tên đi xuống
(4): sai vì biểu diễn electron độc thân bằng mũi tên đi xuống
(5): sai vì số electron độc thân chưa tối đa, biểu diễn electron độc thân bằng mũi tên đi xuống
(6): sai vì biểu diễn 2 electron độc thân bằng mũi tên đi xuống
Bài 2 trang 34 SGK Hóa 10 CTST
Cho nguyên tố X có 2 lớp electron, lớp thứ 2 có 6 electron. Xác định số hiệu nguyên tử của X.
Hướng dẫn giải bài tập
Lớp thứ nhất có 1 phân lớp là 1s
Lớp thứ 2 có 2 phân lớp là 2s và 2p
Phân lớp s chứa tối đa 2 electron, phân lớp p chứa tối đa 6 electron
=> Cấu hình electron của nguyên tố X: 1s22s22p4
=> Nguyên tố X có 8 electron
=> Số hiệu nguyên tử của X: Z = 8
Bài 3 trang 34 SGK Hóa 10 CTST
Ở trạng thái cơ bản, nguyên tử của những nguyên tố nào dưới đây có electron độc thân?
a) Boron
b) Oxygen
c) Phosphorus
d) Chlorine
Hướng dẫn giải bài tập
a) Boron (Z = 5): 1s22s22p1 => Có 1 electron độc thân
b) Oxygen (Z = 8): 1s22s22p4 => Có 2 electron độc thân
c) Phosphorus (Z = 15): 1s22s22p63s23p3 => Có 3 electron độc thân
d) Chlorine (Z = 17): 1s22s22p63s23p5 => Có 1 electron độc thân.
Bài 4 trang 34 SGK Hóa 10 CTST
Viết cấu hình electron nguyên tử của các nguyên tố: carbon (Z = 6), sodium (Z = 11) và oxygen (Z = 8). Cho biết số electron lớp ngoài cùng trong nguyên tử của các nguyên tố trên. Chúng là kim loại, phi kim hay khí hiếm.
Hướng dẫn giải bài tập
Nguyên tố Carbon (Z = 6): 1s22s22p2 => Có 4 electron ở lớp ngoài cùng, là nguyên tố phi kim
Nguyên tố Sodium (Z = 11): 1s22s22p63s1 => Có 1 electron ở lớp ngoài cùng, là nguyên tố kim loại
Nguyên tố Oxygen (Z = 8): 1s22s22p4 => Có 6 electron ở lớp ngoài cùng, là nguyên tố phi kim
