Giải sgk Hoá học 10 bài 5: Cấu tạo bảng tuần hoàn các nguyên tố hóa học
Giải sgk Hoá học 10 bài 5: Cấu tạo bảng tuần hoàn các nguyên tố hóa học
Giải sgk Hoá học 10 bài 5: Cấu tạo bảng tuần hoàn các nguyên tố hóa học có đáp án chi tiết cho từng bài tập trong sách giáo khoa Hoá học 10 Chân trời sáng tạo. Mời các em học sinh cùng quý phụ huynh tham khảo.
Luyện tập, vận dụng
Câu 1 trang 36 SGK Hóa 10 CTST
Quan sát Hình 5.1, hãy mô tả bảng tuần hoàn các nguyên tố hóa học của Mendeleev. Nhận xét về cách sắp xếp các nguyên tố hóa học theo chiều từ trên xuống dưới trong cùng một cột.

Hướng dẫn giải
Cách sắp xếp các nguyên tố hóa học theo chiều từ trên xuống dưới trong cùng một cột:
Trong cùng 1 cột, theo chiều từ trên xuống dưới, các nguyên tố được xếp theo chiều tăng dần của khối lượng nguyên tử.
Câu 2 trang 36 SGK Hóa 10 CTST
Quan sát hai nguyên tố Te và I trong Hình 5.1, em nhận thấy điều gì khác thường?
Hướng dẫn giải
Nguyên tố Te có nguyên tử khối là 128 nhưng lại đứng trước nguyên tố I có nguyên tử khối là 127
Câu 3 trang 36 SGK Hóa 10 CTST
Hãy cho biết các dấu chấm hỏi trong bảng tuần hoàn ở Hình 5.1 có hàm ý gì?
Hướng dẫn giải
Các dấu chấm hỏi trong bảng do vị trí của các nguyên tố trong bảng tuần hoàn không thuận lợi cho việc tiên đoán nên ông chỉ mới ước lượng được khối lượng nguyên tử của chúng.
Câu 4 trang 36 SGK Hóa 10 CTST
Quan sát Hình 5.2, hãy cho biết 3 nguyên tố Sc, Ga và Ge nằm ở vị trí nào trong bảng tuần hoàn của Mendeleev (Hình 5.1).
Hướng dẫn giải
Sc ở vị trí có nguyên tử khối = 45
Ga ở vị trí có nguyên tử khối = 68
Ge ở vị trí có nguyên tử khối = 70
Sc nằm giữa Ca và Er
Ga và Ge nằm giữa Zn và As
Câu 5 trang 38 SGK Hóa 10 CTST
Quan sát Hình 5.3, em hãy nêu các thông tin có trong ô nguyên tố aluminium
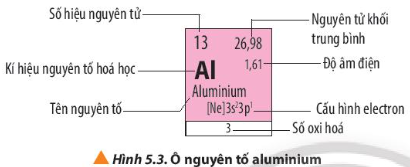
Hướng dẫn giải
Quan sát Hình 5.3, các thông tin có trong ô nguyên tố aluminium:
- Số hiệu nguyên tử là 13
=> Số proton = số electron = số đơn vị điện tích hạt nhân = 13
- Kí hiệu nguyên tố hóa học: Al
- Tên nguyên tố: Aluminium
- Nguyên tử khối trung bình = 27
- Độ âm điện = 1,61
- Cấu hình electron [Ne]3s23p1
=> Al thuộc chu kì 3, nhóm IIIA
- Số oxi hóa của Al trong hợp chất là 3
Luyện tập trang 38 Hóa 10 CTST
Quan sát Hình 5.3, cho biết số electron lớp ngoài cùng, số proton của nguyên tử aluminium
Hướng dẫn giải
Nguyên tử aluminium có 3 electron lớp ngoài cùng, số proton bằng số electron và bằng 13
Câu 6 trang 38 SGK Hóa 10 CTST
Quan sát Hình 5.4, hãy nhận xét về số lớp electron trong nguyên tử của các nguyên tố cùng chu kì.

Hướng dẫn giải
Các nguyên tố thuộc chu kì 2 đều có 2 lớp electron
Các nguyên tố thuộc chu kì 3 đều có 3 lớp electron
Câu 7 trang 38 SGK Hóa 10 CTST
Quan sát Hình 5.2, nhận xét đặc điểm cấu hình electron nguyên tử của các nguyên tố trong cùng một nhóm A
Hướng dẫn giải
Các nguyên tố trong cùng 1 nhóm A sẽ có cùng số electron ở lớp ngoài cùng
Ví dụ:
Nhóm IA, các nguyên tố có 1 electron ở lớp ngoài cùng
Nhóm IIIA, các nguyên tố có 3 electron ở lớp ngoài cùng
Nhóm VIA, các nguyên tố có 6 electron ở lớp ngoài cùng
Câu 8 trang 38 SGK Hóa 10 CTST
Quan sát nhóm VIIIB trong bảng tuần hoàn, cho biết nhóm này có đặc điểm gì khác biệt so với các nhóm còn lại
Hướng dẫn giải
Trong bảng tuần hoàn, mỗi nhóm chỉ có 1 cột riêng nhóm VIIIB có đến 3 cột.
Câu 9 trang 39 SGK Hóa 10 CTST
Quan sát Hình 5.5, nhận xét mối quan hệ giữa số electron hóa trị của nguyên tử với số thứ tự nhóm của nguyên tố nhóm A.
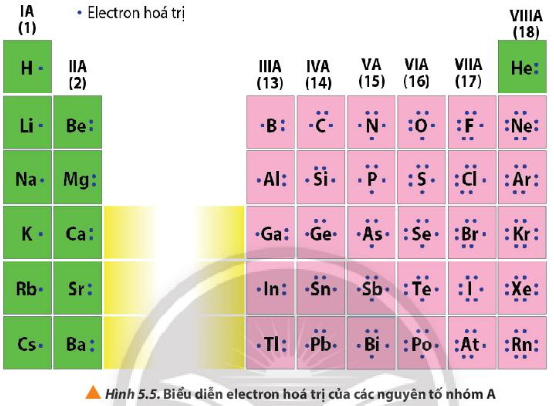
Hướng dẫn giải
Số electron hóa trị của nguyên tử = số thứ tự nhóm của nguyên tố nhóm A
Ví dụ:
+ Nhóm IA, các nguyên tố đều có 1 electron hóa trị
+ Nhóm IIA, các nguyên tố đều có 2 electron hóa trị
Câu 10 trang 39 SGK Hóa 10 CTST
Quan sát Hình 5.2, dựa vào cấu hình electron nguyên tử, hãy nhận xét mối quan hệ giữa số electron hóa trị của nguyên tử các nguyên tố với số thứ tự nhóm của nguyên tố nhóm B. Nêu rõ các trường hợp đặc biệt.
Hướng dẫn giải
Electron hóa trị thường nằm ở lớp ngoài cùng hoặc ở cả phân lớp sát lớp ngoài cùng nếu phân lớp đó chưa bão hòa
Câu 11 trang 39 SGK Hóa 10 CTST
Dựa vào cấu hình electron, cho biết nguyên tố có số hiệu nguyên tử là 6, 8, 18, 20 thuộc khối nguyên tố nào trong bảng tuần hoàn. Chúng là kim loại, phi kim hay khí hiếm?
Hướng dẫn giải
- Nguyên tố có Z = 6
Cấu hình electron: 1s22s22p2
=> Thuộc khối nguyên tố p, có 4 electron ở lớp ngoài cùng => Phi kim
- Nguyên tố có Z = 8:
Cấu hình electron: 1s22s22p4
=> Thuộc khối nguyên tố p, có 6 electron ở lớp ngoài cùng => Phi kim
- Nguyên tố có Z = 18
Cấu hình electron: 1s22s22p63s23p6
=> Thuộc khối nguyên tố p, có 8 electron ở lớp ngoài cùng => Khí hiếm
Nguyên tố có Z = 20
Cấu hình electron: 1s22s22p63s23p64s2
=> Thuộc khối nguyên tố s, có 2 electron ở lớp ngoài cùng => Kim loại.
Luyện tập trang 40 SGK Hóa 10 CTST
Nitrogen là thành phần dinh dưỡng cần thiết cho sự sinh trưởng, phát triển và sinh sản của thực vật. Biết nitrogen có số hiệu nguyên tử là 7.
a) Viết cấu hình electron của nitrogen
b) Nitrogen là nguyên tố s, p, d hay f?
c) Nitrogen là kim loại, phi kim hay khí hiếm?
Hướng dẫn giải
a) Cấu hình electron của nitrogen: 1s22s22p3
b) Dựa vào cấu hình electron ⇒ nitrogen là nguyên tố p
c) Nitrogen có 5 electron lớp ngoài cùng ⇒ Nitrogen là phi kim.
Câu 12 trang 39 SGK Hóa 10 CTST
Quan sát Hình 5.2, nhận xét chiều tăng điện tích hạt nhân nguyên tử các nguyên tố trong chu kì và nhóm
Hướng dẫn giải
Các nguyên tố được xếp theo chiều tăng điện tích hạt nhân nguyên tử các nguyên tố trong chu kì và nhóm
Bài tập
Bài 1 trang 42 SGK Hóa 10 CTST
Viết cấu hình electron nguyên tử và xác định vị trí của các nguyên tố sau trong bảng tuần hoàn. Cho biết chúng thuộc khối nguyên tố nào (s, p, d, f) và chúng là kim loại, phi kim hay khí hiếm:
a) Neon tạo ra ánh sáng màu đỏ khi sử dụng trong các ống phóng điện chân không, được sử dụng rộng rãi trong các biển quảng cáo. Cho biết Ne có số hiệu nguyên tử là 10.
b) Magnesium được sử dụng để làm cho hợp kim bền nhẹ, đặc biệt được ứng dụng cho ngành công nghiệp hàng không. Cho biết Mg có số hiệu nguyên tử là 12.
Hướng dẫn giải bài tập
a) Ne (Z = 10)
Cấu hình electron: 1s22s22p6
+ Ne thuộc khối nguyên tố p
+ Ne có 8 electron lớp ngoài cùng ⇒ là khí hiếm
b) Mg (Z = 12):
Cấu hình electron: 1s22s22p63s2
+ Mg thuộc khối nguyên tố s
+ Mg có 2 electron lớp ngoài cùng ⇒ là kim loại.
Bài 2 trang 42 SGK Hóa 10 CTST
Dãy nào gồm các nguyên tố có tính chất hóa học tương tự nhau? Vì sao?
a) Oxygen (Z = 8), nitrogen (Z = 7), carbon (Z = 6)
b) Lithium (Z = 3), sodium (Z = 11), potassium (Z = 19)
c) Helium (Z = 2), neon (Z = 10), argon (Z = 18)
Hướng dẫn giải
a)
Oxygen (Z = 8): 1s22s22p4 => Có 6 electron lớp ngoài cùng, thuộc nhóm VIA
Nitrogen (Z = 7): 1s22s22p3 => Có 5 electron lớp ngoài cùng, thuộc nhóm VA
Carbon (Z = 6): 1s22s22p2 => Có 5 electron lớp ngoài cùng, thuộc nhóm IVA
=> 3 nguyên tố không thuộc cùng 1 nhóm => Không có tính chất hóa học tương tự nhau
b)
- Lithium (Z = 3):
Cấu hình electron: 1s22s1
=> Có 1 electron lớp ngoài cùng, thuộc nhóm IA
- Sodium (Z = 11)
Cấu hình electron: 1s22s22p63s1
=> Có 1 electron lớp ngoài cùng, thuộc nhóm IA
- Potassium (Z = 19)
Cấu hình electron: 1s22s22p63s23p64s1
=> Có 1 electron lớp ngoài cùng, thuộc nhóm IA
=> 3 nguyên tố cùng thuộc nhóm IA => 3 nguyên tố có tính chất tương tự nhau
c)
- Helium (Z = 2)
Cấu hình electron: 1s2 là nguyên tố đặc biệt, có 2 electron ở lớp ngoài cùng nhưng nằm ở nhóm VIIIA
- Neon (Z = 10)
Cấu hình electron: 1s22s22p6
=> Có 8 electron ở lớp ngoài cùng, thuộc nhóm VIIIA
Bài 3 trang 42 SGK Hóa 10 CTST
Viết cấu hình electron nguyên tử của các nguyên tố sau:
a) Nguyên tố thuộc chu kì 4, nhóm IIA
b) Nguyên tố khí hiếm thuộc chu kì 3
Hướng dẫn giải
a)
Nguyên tố chu kì 4 => Có 4 lớp electron
Nguyên tố nhóm IIA => Có 2 electron ở lớp ngoài cùng
=>Cấu hình electron: 1s22s22p63s23p64s2
b)
Nguyên tố chu kì 3 => Có 3 lớp electron
Nguyên tố khí hiếm => Nhóm VIIIA => Có 8 electron ở lớp ngoài cùng
=> Cấu hình electron 1s22s22p63s23p6
