Giải sgk Hoá học 10 bài 6: Xu hướng biến đổi một số tính chất của nguyên tử các nguyên tố
Giải sgk Hoá học 10 bài 6: Xu hướng biến đổi một số tính chất của nguyên tử các nguyên tố
Giải sgk Hoá học 10 bài 6: Xu hướng biến đổi một số tính chất của nguyên tử các nguyên tố có đáp án chi tiết cho từng bài tập trong sách giáo khoa Hoá học 10 Chân trời sáng tạo. Mời các em học sinh cùng quý phụ huynh tham khảo.
Luyện tập vận dụng
Câu hỏi 1 trang 43 Hóa 10 CTST
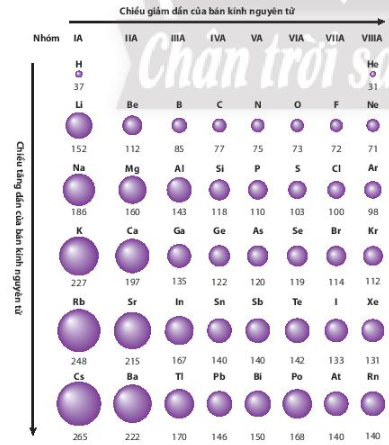
Quan sát Hình 6.1, cho biết bán kính nguyên tử của các nguyên tố trong mỗi chu kì và trong mỗi nhóm A biến đổi như thế nào?
Hướng dẫn giải
Trong mỗi chu kì, đi từ trái sang phải, bánh kính nguyên tử của các nguyên tố giảm dần
Trong mỗi nhóm, đi từ trên xuống dưới, bán kính nguyên tử của các nguyên tố tăng dần
Câu hỏi 2 trang 43 Hóa 10 CTST
Xu hướng biến đổi bán kính nguyên tử của các nguyên tố trong mỗi chu kì và trong mỗi nhóm A do yếu tố nào gây ra? Giải thích.
Hướng dẫn giải
Bán kính nguyên tử của các nguyên tố nhóm A có xu hướng biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân:
+ Trong một chu kì, nguyên tử của các nguyên tố có cùng số lớp electron. Từ trái sang phải, điện tích hạt nhân nguyên tử tăng dần nên electron lớp ngoài cùng sẽ bị hạt nhân hút mạnh hơn, vì vậy bán kính nguyên tử của các nguyên tố có xu hướng giảm dần
+ Trong một nhóm, theo chiều từ trên xuống dưới, số lớp electron tăng dần nên bán kính nguyên tử có xu hướng tăng
Luyện tập trang 44 Hóa 10 CTST
Dựa vào xu hướng biến đổi bán kính nguyên tử của các nguyên tố trong bảng tuần hoàn, em hãy sắp xếp các nguyên tố sau đây theo chiều tăng dần bán kính nguyên tử: Li, N, O, Na, K
Hướng dẫn giải
Li, N, O cùng thuộc chu kì 2
– Li, Na, K cùng thuộc nhóm IA
– Trong 1 chu kì, tính từ trái sang phải, bán kính nguyên tử giảm => Bán kính: Li > N > O (1)
– Trong 1 nhóm, đi từ trên xuống dưới, bánh kính nguyên tử tăng => Bán kính: K > Na > Li (2)
– Từ (1) và (2)
=> Sắp xếp các nguyên tố theo chiều tăng dần bán kính nguyên tử: O < N < Li < Na < K
Câu 3 trang 44 Hóa 10 CTST
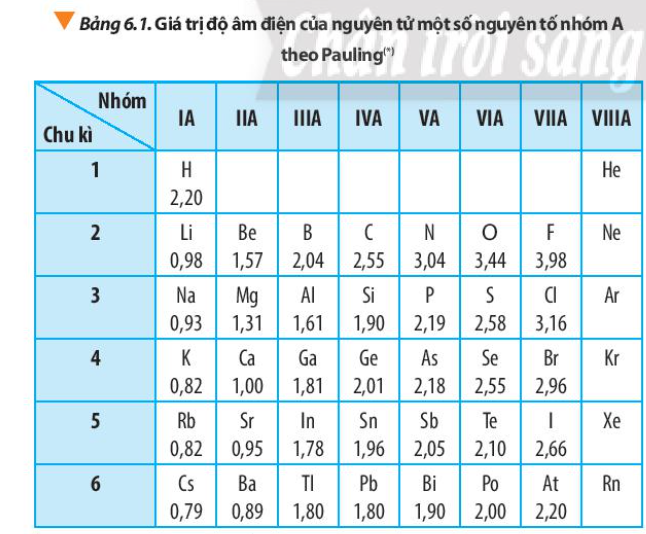
Từ số liệu trong Bảng 6.1, nhận xét sự biến đổi giá trị độ âm điện của nguyên tử các nguyên tố trong một nhóm A và trong một chu kì. Giải thích
Hướng dẫn giải
Độ âm điện của nguyên tử các nguyên tố nhóm A có xu hướng biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân:
+ Trong một chu kì: theo chiều tăng dần của điện tích hạt nhân, lực hút giữa hạt nhân với các electron lớp ngoài cùng cũng tăng. Do đó, độ âm điện của nguyên tử các nguyên tố có xu hướng tăng dần
+ Trong một nhóm, theo chiều tăng dần của điện tích hạt nhân, bán kính nguyên tử tăng nhanh, lực hút giữa hạt nhân với các electron lớp ngoài cùng giảm. Do đó độ âm điện của nguyên tử các nguyên tố có xu hướng giảm dần
Câu 4 trang 44 Hóa 10 CTST
Hãy cho biết vì sao trong Bảng 6.1, giá trị độ âm điện của nguyên tử các nguyên tố nhóm VIIIA còn để trống.
Hướng dẫn giải
Các nguyên tố nhóm VIIIA là các nguyên tố khí hiếm, bền ở điều kiện thường và không tham gia liên kết hóa học
=> Không hút electron vì cấu hình electron đã đạt cấu hình bền vững
=> Không có giá trị độ âm điện
Luyện tập trang 45 Hóa 10 CTST
Dựa vào xu hướng biến đổi độ âm điện của nguyên tử các nguyên tố trong bảng tuần hoàn, em hãy sắp xếp các nguyên tố sau đây theo chiều tăng dần độ âm điện của nguyên tử: Na, K, Mg, Al
Hướng dẫn giải
Na, Mg Al cùng thuộc chu kì 2
– Na, K đều cùng nhóm IA
– Trong 1 chu kì, tính từ trái sang phải, giá trị độ âm điện tăng => Giá trị độ âm điện: Na < Mg < Al (1)
– Trong 1 nhóm, đi từ trên xuống dưới, giá trị độ âm điện giảm => Giá trị độ âm điện: K < Na (2)
– Từ (1) và (2)
=> Sắp xếp các nguyên tố theo chiều tăng dần giá trị độ âm điện: K < Na < Mg < Al
Câu 5 trang 45 Hóa 10 CTST
Giải thích sự hình thành ion Na+ và ion F-
Hướng dẫn giải
Na là kim loại nhóm IA => Có 1 electron ở lớp ngoài cùng => Khi tham gia liên kết dễ dàng nhường đi 1 electron để đạt cấu hình electron bền vững khí hiếm, tạo thành Na+
F là phi kim nhóm VIIA => Có 7 electron ở lớp ngoài cùng => Khi tham gia liên kết dễ dàng nhận thêm 1 electron để đạt cấu hình electron bền vững của khí hiếm, tạo thành F-
Câu 6 trang 45 Hóa 10 CTST
Khả năng nhường hoặc nhận electron hóa trị của các nguyên tử các nguyên tố nhóm A thay đổi như thế nào khi:
a) đi từ đầu chu kì đến cuối chu kì?
b) đi từ đầu nhóm đến cuối nhóm?
Hướng dẫn giải
Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, lực hút giữa hạt nhân với các electron lớp ngoài cùng tăng. Do đó, khả năng nhận electron của các nguyên tử tăng và khả năng nhường electron của các nguyên tử giảm
Trong một nhóm, theo chiều tăng dần của điện tích hạt nhân, lực hút giữa hạt nhân với các electron lớp ngoài cùng giảm. Do đó, khả năng nhận electron của các nguyên tử giảm và khả năng nhường electron của các nguyên tử tăng
Luyện tập trang 46 Hóa 10 CTST
Dựa vào xu hướng biến đổi tính kim loại – phi kim của các nguyên tố trong bảng tuần hoàn, hãy sắp xếp các nguyên tố sau đây theo chiều giảm dần tính kim loại: sodium, magnesium và potassium
Hướng dẫn giải
Na, Mg thuộc cùng chu kì 2
Na, K thuộc cùng nhóm IA
Trong cùng 1 chu kì, tính theo chiều tăng dần điện tích hạt nhân, tính kim loại giảm dần => Tính kim loại Na > Mg (1)
Trong cùng 1 nhóm, tính theo chiều tăng dần điện tích hạt nhân, tính kim loại tăng dần => Tính kim loại K > Na (2)
Từ (1) và (2)
=> Sắp xếp các nguyeenn tố theo chiều giảm dần tính kim loại: K > Na > Mg
Câu 7 trang 46 Hóa 10 CTST
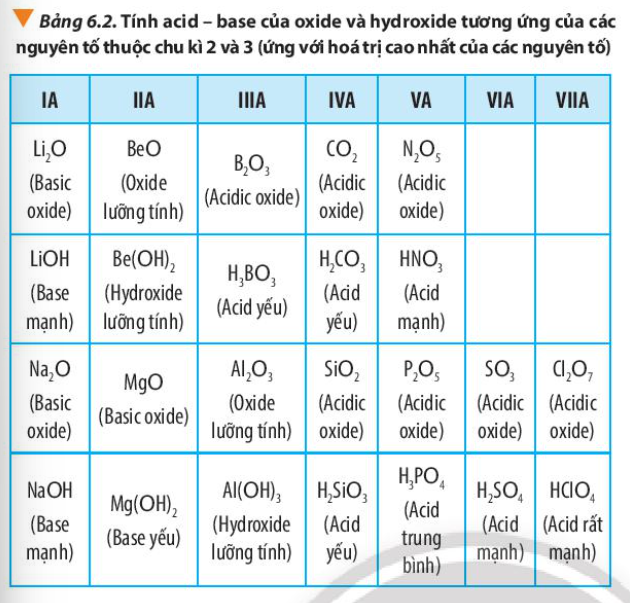
Từ các phản ứng của các oxide và hydroxide: Na2O, NaOH, Al2O3, Al(OH)3, SO3, H2SO4 với các dung dịch HCl, KOH, hãy nhận xét tính acid, base của các oxide và hydroxide trên
Hướng dẫn giải
Tính acid, base của oxide
+ Na2O phản ứng với acid
+ Al2O3 phản ứng với cả acid và base
+ SO3 phản ứng với acid
=> Tính base: Na2O > Al2O3 > SO3.
Tính acid: Na2O < Al2O3 < SO3
– Tính acid, base của hydroxide
+ NaOH phản ứng với acid
+ Al(OH)3 phản ứng với acid và base
+ H2SO4 phản ứng với base
=> Tính base: NaOH > Al(OH)3 > H2SO4. Tính acid: NaOH < Al(OH)3 < H2SO4
Câu 8 trang 47 Hóa 10 CTST
Quan sát Bảng 6.2, hãy liên hệ xu hướng biến đổi tính acid, tính base của oxide và hydroxide tương ứng với tính kim loại, phi kim của các nguyên tố trong chu kì.
Hướng dẫn giải
Trong 1 chu kì:
+ Tính kim loại giảm dần, tính phi kim tăng dần.
+ Tính base của oxide, hydroxide giảm dần; tính acid của oxide, hydroxide tăng dần
Luyện tập trang 47 Hóa 10 CTST
Dựa vào xu hướng biến đổi tính acid – base của oxide và hydroxide tương ứng của các nguyên tố trong bảng tuần hoàn, hãy sắp xếp các hợp chất sau đây theo chiều giảm dần tính acid của chúng: H2SiO3, HClO4, H2SO4, H3PO4
Hướng dẫn giải
Trong cùng 1 chu kì, tính từ trái trang phải, tính acid của hydroxide tương ứng của các nguyên tố trong bảng tuần hoàn tăng dần
=> Sắp xếp theo chiều giảm dần tính acid: HClO4 > H2SO4> H3PO4 > H2SiO4
Bài tập
Bài 1 trang 47 Hóa 10 Chân trời sáng tạo
Nguyên tử của nguyên tố nào sau đây có bán kính nhỏ nhất?
A. Si (Z = 14)
B. P (Z = 15)
C. Ge (Z = 32)
D. As (Z = 33)
Hướng dẫn giải bài tập
Trong một chu kì, theo chiều tăng của điện tích hạt nhân, bán kính nguyên tử giảm dần.
Trong một nhóm, theo chiều tăng của điện tích hạt nhân, bán kính nguyên tử tăng dần.
Si (Z = 14), P (Z = 15) cùng thuộc chu kì 3.
⇒ Bán kính: Si > P (1)
Si (Z = 14), Ge (Z = 32) cùng thuộc nhóm IVA
⇒ Bán kính: Ge > Si (2)
Từ (1), (2) ⇒ Ge > Si > P
P (Z = 15), As (Z = 33) cùng thuộc nhóm VA
⇒ Bán kính: As > P
Vậy bán kính của P (Z = 15) là nhỏ nhất
Bài 2 trang 48 Hóa 10 Chân trời sáng tạo
Bốn nguyên tố D, E, M, Q cùng thuộc một nhóm A trong bảng tuần hoàn, có số hiệu nguyên tử lần lượt là 9, 17, 35, 53. Các nguyên tố này được sắp xếp theo chiều tính phi kim tăng dần theo dãy nào sau đây?
A. D, Q, E, M
B. Q, M, E, D
C. D, E, M, Q
D. D, M, E, Q
Hướng dẫn giải bài tập
D: số hiệu nguyên tử = 9 => nhóm VIIA, chu kì 2
E: số hiệu nguyên tử = 17 => nhóm VIIA, chu kì 3
M: số hiệu nguyên tử = 35 => nhóm VIIA, chu kì 4
Q: số hiệu nguyên tử = 53 => nhóm VIIA, chu kì 5
Cả 4 nguyên tố đều thuộc nhóm VIIA.
Trong cùng 1 nhóm, theo chiều tăng dần điện tích hạt nhân, tính phi kim giảm dần
=> Sắp xếp theo chiều tính phi kim tăng dần: Q < M < E < D
Bài 3 trang 48 Hóa 10 Chân trời sáng tạo
Xét ba nguyên tố có cấu hình electron lần lượt:
X: 1s22s22p63s1
Y: 1s22s22p63s2
Z: 1s22s22p63s23p1
Tính tăng dần của hydroxide là
A. XOH < Q(OH)2 < Z(OH)3
B. Z(OH)3 < XOH < Q(OH)2
C. Z(OH)3 < Q(OH)2 < XOH
D. XOH < Z(OH)3 < Q(OH)2
Hướng dẫn giải bài tập
X: 1s22s22p63s1: nhóm IA, chu kì 3
Q: 1s22s22p63s2: nhóm IIA, chu kì 3
Z: 1s22s22p63s23p1: nhóm IIIA, chu kì 3
Trong cùng 1 chu kì, đi từ trái sang phải, tính base của hydroxide giảm dần
=> Z(OH)3 < Q(OH)2< XOH
Bài 4 trang 48 Hóa 10 Chân trời sáng tạo
Trong bảng tuần hoàn các nguyên tố hóa học, cho biết nguyên tố nào có tính phi kim mạnh nhất. Giải thích.
Hướng dẫn giải bài tập
Tính chất đặc trưng của phi kim là khả năng hút electron của nguyên tố
=> Nguyên tố nào có độ âm điện càng lớn thì khả năng hút electron càng mạnh
Nguyên tố F có độ âm điện lớn nhất trong bảng tuần hoàn
=> F có có tính phi kim mạnh nhất
Bài 5 trang 48 Hóa 10 Chân trời sáng tạo
Cho bảng số liệu sau:
| Kim loại kiềm | Bán kính nguyên tử (pm) | Độ âm điện |
| Li | 152 | 0,98 |
| Na | 186 | 0,93 |
| K | 227 | 0,82 |
| Rb | 248 | 0,82 |
| Cs | 265 | 0,79 |
Hãy vẽ đồ thị hoặc biểu đồ với hai đại lượng bán kính nguyên tử và độ âm điện trong bảng số liệu trên. Quan sát và cho biết hai đại lượng này biến thiên như thế nào? Giải thích.
