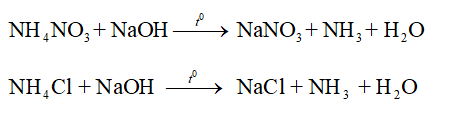Hoá học 11 trang 34 Bài 5: Ammonia – Muối Ammonium
Hoá học 11 trang 34 Bài 5: Ammonia – Muối Ammonium
Giải Hoá học 11 trang 34 Bài 5: Ammonia – Muối Ammonium sách Kết nối tri thức có đáp án chi tiết cho từng bài tập trong sách giáo khoa Hoá học lớp 11. Mời các em học sinh cùng quý phụ huynh tham khảo.
Trang 33 Hoá học 11
Mở đầu trang 33 SGK Hoá học 11
Từ ammonia, thông qua phản ứng nào có thể sản xuất phân đạm chứa ion ammonium? Ammonia đóng vai trò gì trong phản ứng đó?
Lời giải:
Trong công nghiệp, phản ứng giữa ammonia với acid được dùng để sản xuất phân bón.
Ví dụ:
NH3 + HCl → NH4Cl
NH3 + HNO3 → NH4NO3
2NH3 + H2SO4 → (NH4)2SO4
Trong các phản ứng này ammonia đóng vai trò là base.
Phản ứng sản xuất phân bón: ammonia với acid.
Vai trò của ammonia: base.
Câu hỏi 1 trang 33 SGK Hoá học 11
1. Viết cấu hình electron của các nguyên tử H (Z = 1) và N (Z = 7).
2. Trình bày các bước lập công thức Lewis của phân tử ammonia.
Lời giải chi tiết:
1. Cấu hình electron nguyên tử H (Z = 1): 1s1.
Cấu hình electron nguyên tử N (Z = 7): 1s2 2s2 2p3.
2. Các bước lập công thức Lewis của phân tử ammonia (NH3):
Cách 1: Viết công thức Lewis dựa vào công thức electron
Bước 1: Viết công thức electron:
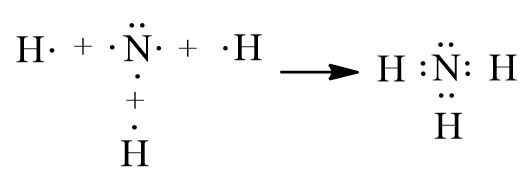
Bước 2: Từ công thức electron, thay 1 cặp electron dùng chung bằng 1 gạch nối giữa hai nguyên tử ta được công thức Lewis:
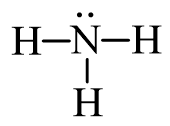
Trang 34 Hoá học 11
Câu 2 trang 34 SGK Hoá học 11
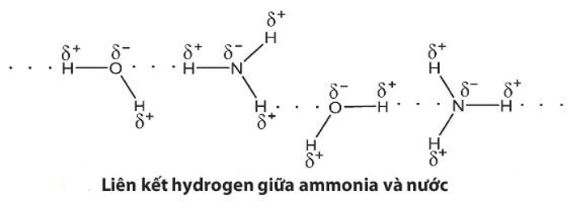
Từ đặc điểm cấu tạo của phân tử ammonia, hãy giải thích tại sao các phân tử ammonia có khả năng tạo liên kết hydrogen mạnh với nhau.
Lời giải
Trong phân tử nitrogen:
– Nguyên tử nitrogen còn một cặp electron không liên kết, tạo ra vùng có mật độ điện tích âm trên nguyên tử nitrogen.
– Liên kết N – H phân cực, cặp electron dùng chung lệch về phía nguyên tử nitrogen làm cho nguyên tử hydrogen mang một phần điện tích dương.
Do đó, các phân tử ammonia có khả năng tạo liên kết hydrogen mạnh với nhau.
Câu 3 trang 34 SGK Hoá học 11
Hãy giải thích tại sao ammonia tan tốt trong nước
Lời giải
Vì tạo được liên kết hydrogen với nước nên ammonia tan nhiều trong nước.
Câu 4 trang 34 SGK Hoá học 11
Trong hai phản ứng oxi hoá ammonia bằng oxygen ở trên, hãy:
a) Xác định các nguyên tử có sự thay đổi số oxi hoá.
b) Viết quá trình oxi hoá, quá trình khử.
Lời giải
a) Các nguyên tử có sự thay đổi số oxi hoá trong 2 phản ứng là nitrogen và oxygen.

b) 4NH3 + 3O2 \(\overset{t^{0} }{\rightarrow}\) 2N2 + 6H2O
Quá trình oxi hoá: 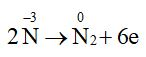
Quá trình khử: ![]()
4NH3+ 5O2 \(\overset{t^{0} , Pt}{\rightarrow}\) 4NO + 6H2O
Quá trình oxi hoá: ![]()
Quá trình khử: ![]()
Trang 37 Hoá học 11
Câu 5 trang 37 SGK Hoá học 11
a) So sánh phân tử ammonia và ion ammonium về dạng hình học, số liên kết cộng hoá trị, số oxi hoá của nguyên tử nitrogen.
b) Viết phương trình hoá học minh hoạ tính acid/base của ammonia và ammonium.
Lời giải
a)
| Phân tử/ Ion | Dạng hình học | Số liên kết cộng hoá trị của nitrogen | Số oxi hoá của nitrogen |
| Ammonia (NH3) |  | 3 | -3 |
| Ammonium (NH4+) | 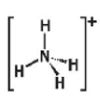 | 4 | -3 |
b)
– NH3 có tính base. Một số phương trình hoá học minh hoạ:
NH3 + HCl → NH4Cl
2NH3 + H2SO4 → (NH4)2SO4.
– NH4 có tính acid. Một số phương trình hoá học minh hoạ:
NH4NO3 + NaOH \(\overset{t^{0} }{\rightarrow}\) NaNO3 + NH3 + H2O
NH4Cl + NaOH \(\overset{t^{0} }{\rightarrow}\) NaCl + NH3 + H2O
Phương trình ion rút gọn:
NH+4 + OH– → NH3 + H2O.
Câu hỏi 6 trang 37 Hoá học 11
Vận dụng được kiến thức về cân bằng hoá học, tốc độ phản ứng, enthalpy cho phản ứng tổng hợp ammonia trong quá trình Haber – Bosch.
– Nhận biết được ion ammonium trong phân đạm.
Lời giải chi tiết:
– Trong công nghiệp, quá trình sản xuất ammonia thường được thực hiện ở nhiệt độ 400 oC – 450 oC, áp suất 150 – 200 bar, xúc tác Fe.
N2(g) + 3H2(g) ⇌ 2NH3(g) ΔrHo = -91,8 kJ
+ Về áp suất: người ta đã tăng áp suất của hệ phản ứng trong buồng tổng hợp lên đến gần 200 bar. Đó là do khi tăng áp suất, cân bằng chuyển dịch theo chiều làm giảm áp suất của hệ – tức chiều giảm số mol khí, hay chiều tạo ammonia (chiều thuận).
+ Về nhiệt độ: Vì phản ứng thuận toả nhiệt (ΔrHo = -91,8 kJ < 0) nên cần phải giảm nhiệt độ để cân bằng chuyển dịch theo chiều thuận, tạo ammonia. Tuy nhiên, khi thực hiện phản ứng ở nhiệt độ quá thấp thì tốc độ của phản ứng nhỏ, phản ứng diễn ra chậm. Thực tế, người ta đã chọn nhiệt độ phù hợp, khoảng 400 oC – 450 oC.
+ Việc sử dụng xúc tác là bột sắt trong quá trình Haber có tác dụng làm cho phản ứng nhanh đạt tới trạng thái cân bằng.
– Nhận biết ion ammonium trong phân đạm: Khi đun nóng hỗn hợp phân đạm chứa muối ammonium với dung dịch kiềm sinh ra khí ammonia có mùi khai.
Phương trình hoá học minh hoạ: